Elektroliza — zasada działania, cel i zastosowanie
Procesy elektrolizy
 Elektroliza jest szeroko rozpowszechniona w metalurgii metali nieżelaznych oraz w wielu gałęziach przemysłu chemicznego. Metale takie jak aluminium, cynk, magnez otrzymywane są głównie na drodze elektrolizy. Ponadto elektroliza służy do rafinacji (oczyszczania) miedzi, niklu, ołowiu, a także do produkcji wodoru, tlenu, chloru i szeregu innych chemikaliów.
Elektroliza jest szeroko rozpowszechniona w metalurgii metali nieżelaznych oraz w wielu gałęziach przemysłu chemicznego. Metale takie jak aluminium, cynk, magnez otrzymywane są głównie na drodze elektrolizy. Ponadto elektroliza służy do rafinacji (oczyszczania) miedzi, niklu, ołowiu, a także do produkcji wodoru, tlenu, chloru i szeregu innych chemikaliów.
Istotą elektrolizy jest oddzielenie cząstek substancji od elektrolitu, gdy przez kąpiel elektrolityczną przepływa prąd stały i ich osadzanie na elektrodach zanurzonych w kąpieli (elektroekstrakcja) lub gdy substancje są przenoszone z jednej elektrody przez elektrolit do drugiej ( rafinacja elektrolityczna). W obu przypadkach celem procesów jest uzyskanie jak najczystszych substancji, które nie są zanieczyszczone zanieczyszczeniami.
W przeciwieństwie przewodność elektronowa metali w elektrolitach (roztwory soli, kwasów i zasad w wodzie i niektórych innych rozpuszczalnikach, a także w stopionych związkach), obserwuje się przewodnictwo jonowe.
Elektrolity są przewodnikami drugiej klasy.W tych roztworach i stopach zachodzi dysocjacja elektrolityczna — rozpad jonów naładowanych dodatnio i ujemnie.
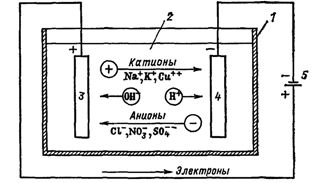
Jeśli elektrody podłączone do źródła energii elektrycznej zostaną umieszczone w naczyniu z elektrolitem - elektrolizerem, wówczas zacznie w nim płynąć prąd jonowy, a dodatnio naładowane jony - kationy przesuną się do katody (są to głównie metale i wodór ) i jony naładowane ujemnie — aniony (chlor, tlen) — do anody.
Na anodzie aniony oddają swój ładunek i stają się neutralnymi cząsteczkami, które osadzają się na elektrodzie. Na katodzie kationy pobierają elektrony z elektrody i również są neutralizowane, osadzając się na niej, a gazy uwalniane na elektrodach w postaci pęcherzyków unoszą się.
Ryż. 1. Procesy podczas elektrolizy. Obwód kąpieli elektrycznej: 1 — kąpiel, 2 — elektrolit, 3 — anoda, 4 — katoda, 5 — zasilanie
Prąd elektryczny w obwodzie zewnętrznym to ruch elektronów od anody do katody (ryc. 1). W takim przypadku roztwór jest zubożony i aby zachować ciągłość procesu elektrolizy należy go wzbogacić. W ten sposób niektóre substancje są ekstrahowane z elektrolitu (elektroekstrakcja).

Jeśli elektroda zostanie umieszczona w roztworze z jonami tej samej substancji, z której jest wykonana, to przy pewnym potencjale między elektrodą a roztworem ani elektroda się nie rozpuści, ani nie osadza się na niej substancja z roztworu.
Ten potencjał nazywa się normalnym potencjałem substancji. Jeśli do elektrody zostanie przyłożony bardziej ujemny potencjał, rozpocznie się na niej uwalnianie substancji (proces katodowy), ale jeśli jest on bardziej dodatni, rozpocznie się jej rozpuszczanie (proces anodowy).
Wartość potencjałów normalnych zależy od stężenia jonów i temperatury. Ogólnie przyjmuje się, że normalny potencjał wodoru wynosi zero. Tabela 1 pokazuje normalne potencjały elektrod niektórych wodnych roztworów substancji w temperaturze + 25 ° C.
Tabela 1. Normalne potencjały elektrod przy + 25 ° C
Jeśli elektrolit zawiera jony różnych metali, to jony o niższym ujemnym potencjale normalnym (miedź, srebro, ołów, nikiel) są rozdzielane najpierw na katodzie; metale ziem alkalicznych są najtrudniejsze do wyizolowania. Ponadto w roztworach wodnych zawsze znajdują się jony wodoru, które zostaną uwolnione wcześniej niż wszystkie metale o ujemnym potencjale normalnym, dlatego podczas elektrolizy tych ostatnich znaczna lub nawet większość energii jest zużywana na uwalnianie wodoru .
Za pomocą specjalnych środków możliwe jest zapobieganie wydzielaniu się wodoru w pewnych granicach, ale metali o normalnym potencjale mniejszym niż 1 V (na przykład magnez, aluminium, metale ziem alkalicznych) nie można uzyskać przez elektrolizę z roztwór wodny. Otrzymuje się je przez rozkład stopionych soli tych metali.
Normalne potencjały elektrodowe substancji wskazanych w tabeli.1, są minimalne, przy których rozpoczyna się proces elektrolizy, w praktyce do rozwoju procesu potrzebne są duże wartości potencjału.
Różnica między rzeczywistym potencjałem elektrody podczas elektrolizy a jej normalnym potencjałem nazywana jest przepięciem. Zwiększa straty energii podczas elektrolizy.
Z drugiej strony zwiększenie przepięcia dla jonów wodorowych utrudnia ich uwolnienie na katodzie, co umożliwia otrzymanie na drodze elektrolizy z roztworów wodnych szeregu metali bardziej ujemnych niż wodór, takich jak ołów, cyna, nikiel , kobalt, chrom, a nawet cynk. Osiąga się to poprzez prowadzenie procesu przy zwiększonych gęstościach prądu na elektrodach, a także wprowadzanie określonych substancji do elektrolitu.
Przebieg reakcji katodowych i anodowych podczas elektrolizy określają następujące dwa prawa Faradaya.
1. Masa substancji md uwolnionej podczas elektrolizy na katodzie lub przepuszczonej z anody do elektrolitu jest proporcjonalna do ilości energii elektrycznej przepuszczonej przez elektrolit Azτ: me = α/τ, gdzie a jest elektrochemicznym równoważnikiem substancji , g / C.
2. Masa substancji uwolnionej podczas elektrolizy przy tej samej ilości energii elektrycznej jest wprost proporcjonalna do masy atomowej substancji A i odwrotnie proporcjonalna do jej wartościowości n: mNS = A / 96480n, tutaj 96480 to liczba Faradaya, C x mol -1 .
W ten sposób elektrochemiczny równoważnik substancji α= A / 96480n reprezentuje masę substancji w gramach uwolnioną przez jednostkę ilości energii elektrycznej przechodzącej przez kąpiel elektrolityczną — kulomb (amperosekunda).
Dla miedzi A=63,54, n=2, α=63,54/96480-2= 0,000329 g/C, dla niklu α=0,000304 g/C, dla cynku α=0,00034 g/C

Stosunek masy faktycznie uwolnionej substancji do jej masy, która powinna była zostać uwolniona zgodnie z prawem Faradaya, nazywa się wydajnością bieżącą substancji η1.
Dlatego dla procesu rzeczywistego mNS = η1 NS (A / 96480n) NS It
Oczywiście zawsze η1
Wydajność prądowa jest istotnie zależna od gęstości prądu elektrody. Wraz ze wzrostem gęstości prądu elektrody wzrasta wydajność prądowa i zwiększa się wydajność procesu.
Na napięcie Uel, które należy dostarczyć do elektrolizera składają się: napięcie przebicia Ep (różnica potencjałów reakcji anodowej i katodowej), suma przepięć anodowych i katodowych, spadek napięcia w elektrolicie Ep, spadek napięcia w elektrolicie Ue = IRep (Rep — opór elektrolityczny), spadek napięcia w oponach, stykach, elektrodach Uc = I(Rw +Rto +RNS). Otrzymujemy: Uel = Ep + Ep + Ue + Us.
Moc pobierana podczas elektrolizy jest równa: Rel = IUmail = I(Ep + Ep + Ue + Uc)
Z tej mocy tylko pierwsza składowa jest wykorzystywana do prowadzenia reakcji, reszta to straty ciepła procesu. Tylko podczas elektrolizy stopionych soli część ciepła uwolnionego w elektrolicie IUe jest zużycie wykorzystana, ponieważ jest zużywana na topienie soli naładowanych w elektrolizerze.
Wydajność kąpieli elektrolizy można oszacować na podstawie masy substancji w gramach uwolnionej na 1 J zużytej energii elektrycznej.Wartość ta nazywana jest wydajnością energetyczną substancji i można ją znaleźć za pomocą wyrażenia qe = (αη1) /Uel100, gdzie α — elektrochemiczny równoważnik substancji, g / C, η1 — prąd wyjściowy, Uemail — napięcie elektrolitu komórka, W.