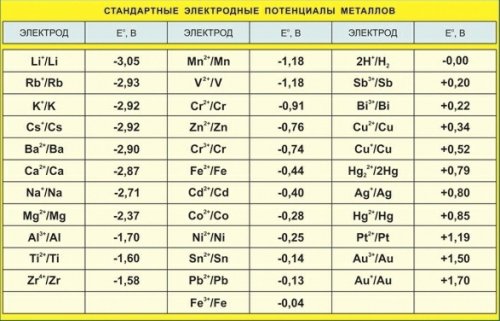
Jaki jest potencjał elektrody
Potencjał elektrody lub potencjał elektrody metalu to różnica potencjałów, która występuje na granicy faz metal-roztwór, gdy metal jest zanurzony w roztworze elektrolitu w wyniku oddziaływania powierzchniowych atomów jonów metalu znajdujących się w węzłach sieci krystalicznej z polarnymi cząsteczki wody zorientowane na powierzchnię elektrody ... Wynika to z tworzenia się podwójnej warstwy elektrycznej, czyli asymetrycznego rozkładu naładowanych cząstek na granicy.
Zjawisko rozpuszczania metali w elektrolitach jest wykorzystywane w chemicznych źródłach energii elektrycznej. Metalowa płyta wędzona w roztworze własnej soli, w taki czy inny sposób, ma tendencję do rozpuszczania się w nim. Ta tendencja jest czasami nazywana elastycznością rozpuszczania metalu.
Płytka cynkowa zanurzona w roztworze siarczanu cynku ZnTAKA4 oddaje do roztworu cząsteczki cynku w postaci dodatnio naładowanych jonów.Ze względu na to, że różowe atomy odchodzą w postaci dodatnio naładowanych jonów, na płytce cynkowej tworzy się nadmiar wolnych elektronów i staje się ona naładowana ujemnie, a nadmiar jonów dodatnich tworzy się w warstwie cieczy przy powierzchni cynku, a zatem warstwa ta jest obciążona dodatnio. W ten sposób na styku cieczy z metalem powstaje podwójna warstwa elektryczna przestrzennie rozdzielonych ładunków o przeciwnych znakach.
Ładunki te będą przeciwdziałać dalszemu przechodzeniu metalu do roztworu - ujemne płytki zatrzymują dodatni jon metalu, a dodatni ładunek elektrolitu popycha jon metalu z powrotem w kierunku płytki. Innymi słowy, pole elektryczne warstwy podwójnej na granicy faz metal-ciecz przeciwdziała dalszemu przechodzeniu jonów metali w roztwór. Ustanawia się równowaga między siłami tendencji metalu do przechodzenia do roztworu, o charakterze chemicznym, a siły elektryczne, które są przeciwne.
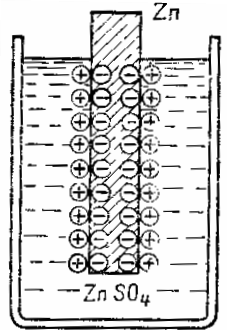
Schemat tworzenia podwójnej warstwy elektrycznej na granicy faz między metalem a elektrolitem
Tak więc, w wyniku rozpuszczania się w elektrolicie, elektroda metalowa uzyskuje pewien potencjał elektrody (innymi słowy elektrochemiczny) w stosunku do elektrolitu, który zależy od materiału elektrody i składu elektrolitu.
Jednak potencjały elektrod mogą być dodatnie. Dzieje się tak w przypadkach, gdy jony dodatnie roztworu przechodzą na elektrodę, ładując ją dodatnio, a warstwę elektrolitu - ujemnie, na przykład, gdy miedziana płytka jest zanurzona w wystarczająco stężonym roztworze siarczanu miedzi (CuSO)4).
Podwójną warstwę elektryczną można porównać do kondensatora, którego jedną z okładek jest powierzchnia metalu, a drugą warstwą jonów w roztworze na powierzchni metalu. Pomiędzy przeciwnie naładowanymi płytami występuje różnica lub skok potencjału.
Skok potencjału na granicy elektroda-roztwór może służyć jako miara zdolności redoks układu. Jednak niemożliwe jest zmierzenie takiego skoku potencjału lub równoważnej różnicy potencjałów między dwiema fazami. Ale możesz zmierzyć e. itp. c. elementów składających się z interesujących nas elektrod i jednej (tej samej we wszystkich przypadkach) elektrody, której potencjał warunkowo przyjmuje się jako zerowy.
Zostało zmierzone itp. c. scharakteryzuje pojemność redoks interesującej nas elektrody względem pewnego warunkowego zera. Uzyskana w ten sposób wartość nazywana jest wewnętrznym potencjałem metalu.
Aby zmierzyć potencjał elektrody dowolnego metalu, konieczne jest umieszczenie drugiej elektrody w elektrolicie, która z kolei będzie miała określony potencjał elektrody, w zależności od materiału, z którego została wykonana. Dlatego tylko algebraiczna suma potencjałów dwóch elektrod może być mierzona bezpośrednio.
Z tego powodu potencjały elektrod różnych materiałów są określane w odniesieniu do wzorca (elektrody wodorowej, której potencjał zwykle przyjmuje się jako zerowy.
Do pomiaru można również zastosować inne elektrody odniesienia, których potencjał względem wzorcowej elektrody wodorowej jest znany. Potencjał ten stwierdza się również na podstawie pomiaru e. itp. c. obwód składający się z wybranej elektrody odniesienia i wzorcowej elektrody wodorowej.
Jeśli badana elektroda podłączona do standardowej elektrody wodorowej jest ujemna, to potencjałowi wewnętrznemu przypisywany jest znak » -», w przeciwnym razie znak «+».
Na przykład potencjał elektrody cynku -0,76 V, miedzi +0,34 V, srebra +0,8 V, mierzony w ten sposób w roztworze odpowiedniej soli metalu, jest określany przez odjęcie potencjału bardziej ujemnego od potencjału na -dodatnim.
Jeśli dwie metalowe płytki o różnym potencjale elektrody umieścimy w odpowiednim elektrolicie, na przykład w roztworze kwasu siarkowego (H2SO4) cynku (Zn) i miedzi (Cth), to woltomierz podłączony do tych płytek wskaże napięcie między im nieco więcej niż 1 V.
To napięcie, w tym przypadku zwane e. itp. c. para galwaniczna, będzie spowodowana różnicą potencjałów elektrod miedzi, która ma mały potencjał dodatni, i cynku, który ma znaczny potencjał ujemny. Takim urządzeniem jest najprostsze ogniwo galwaniczne — ogniwo Volta.
W ogniwie galwanicznym energia chemiczna jest przekształcana w energię elektryczną i za jej pomocą możliwe jest wykonywanie pracy elektrycznej dzięki energii reakcji chemicznej.
Pomiar e. itp. c. ogniwa galwaniczne muszą być wytwarzane przy braku prądu w obwodzie ogniwa. W przeciwnym razie zmierzone e. itp. s. będzie mniejsza niż wartość zdefiniowana jako różnica potencjałów równowagowych obu elektrod… W rzeczywistości pewne stężenie elektronów na elektrodach odpowiada potencjałowi równowagi: im bardziej dodatni jest niższy, tym bardziej ujemny jest wyższy. Odpowiednio, struktura tej części warstwy podwójnej, która jest w roztworze, jest również inna.
Pomiar e. itp. zogniwo bez przepływu prądu jest zwykle wytwarzane metodą kompensacji. Aby go zastosować, musisz go mieć standardowe itp. z Takim standardem jest tak zwany normalny element. Najczęściej używają normalnego pierwiastka rtęciowo-kadmowego Westona, np. itp. z. który jest równy 1,01830 V przy 20 ° C.