Prąd elektryczny w elektrolitach
Prąd elektryczny w elektrolitach jest zawsze związany z przenoszeniem materii. Na przykład w metalach i półprzewodnikach materia, gdy przepływa przez nie prąd, nie jest przenoszona, ponieważ w tych ośrodkach elektrony i dziury są nośnikami prądu, ale w elektrolitach są przenoszone. Dzieje się tak dlatego, że w elektrolitach dodatnio i ujemnie naładowane jony substancji działają jako nośniki wolnych ładunków, a nie elektrony czy dziury.
Do elektrolitów należą stopione związki wielu metali, a także niektóre ciała stałe. Ale głównymi przedstawicielami tego typu przewodników, które są szeroko stosowane w technologii, są wodne roztwory kwasów nieorganicznych, zasad i soli.
Substancja, gdy prąd elektryczny przepływa przez ośrodek elektrolitu, jest uwalniana na elektrodach. Zjawisko to nazywa się elektroliza… Kiedy prąd elektryczny przepływa przez elektrolit, dodatnio i ujemnie naładowane jony substancji poruszają się jednocześnie w przeciwnych kierunkach.
Jony naładowane ujemnie (aniony) pędzą do dodatniej elektrody źródła prądu (anody), a jony naładowane dodatnio (kationy) do jego bieguna ujemnego (katody).
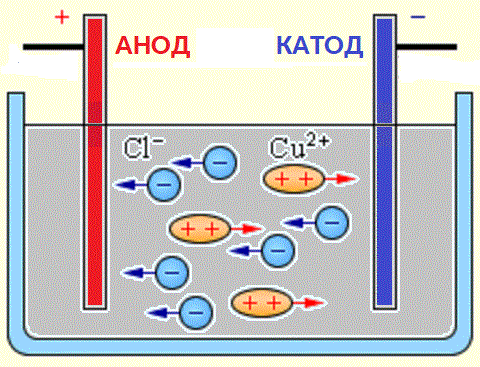
Źródłem jonów w wodnych roztworach kwasów, zasad i soli są obojętne cząsteczki, z których część ulega rozszczepieniu pod działaniem przyłożonej siły elektrycznej. To zjawisko rozszczepiania obojętnych cząsteczek nazywa się dysocjacją elektrolityczną. Na przykład chlorek miedzi CuCl2 rozkłada się podczas dysocjacji w roztworze wodnym na jony chlorkowe (naładowane ujemnie) i miedź (naładowane dodatnio).
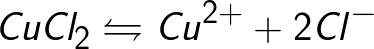
Kiedy elektrody są podłączone do źródła prądu, pole elektryczne zaczyna oddziaływać na jony w roztworze lub stopieniu, gdy aniony chloru przemieszczają się do anody (elektroda dodatnia), a kationy miedzi do katody (elektroda ujemna).
Po dotarciu do elektrody ujemnej dodatnio naładowane jony miedzi są neutralizowane przez nadmiar elektronów na katodzie i stają się neutralnymi atomami, które osadzają się na katodzie. Po dotarciu do elektrody dodatniej, ujemnie naładowane jony chloru przekazują po jednym elektronie podczas interakcji z ładunkiem dodatnim na anodzie. W tym przypadku utworzone obojętne atomy chloru łączą się parami, tworząc cząsteczki Cl2, a chlor jest uwalniany w postaci pęcherzyków gazu na anodzie.
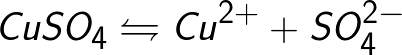
Często procesowi elektrolizy towarzyszy oddziaływanie produktów dysocjacji (nazywa się to reakcjami wtórnymi), gdy uwalniane na elektrodach produkty rozkładu oddziałują z rozpuszczalnikiem lub bezpośrednio z materiałem elektrody. Weźmy na przykład elektrolizę wodnego roztworu siarczanu miedzi (siarczan miedzi — CuSO4).W tym przykładzie elektrody będą wykonane z miedzi.
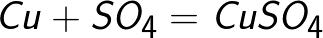
Cząsteczka siarczanu miedzi dysocjuje, tworząc dodatnio naładowany jon miedzi Cu + i ujemnie naładowany jon siarczanowy SO4-. Obojętne atomy miedzi osadzają się na katodzie w postaci stałego osadu. W ten sposób otrzymuje się chemicznie czystą miedź.
Jon siarczanowy przekazuje dwa elektrony do elektrody dodatniej i staje się obojętnym rodnikiem SO4, który natychmiast reaguje z anodą miedzianą (reakcja anody wtórnej). Produktem reakcji na anodzie jest siarczan miedzi, który przechodzi do roztworu.
Okazuje się, że gdy prąd elektryczny przepływa przez wodny roztwór siarczanu miedzi, anoda miedziana po prostu stopniowo się rozpuszcza, a miedź wytrąca się na katodzie.W tym przypadku stężenie wodnego roztworu siarczanu miedzi nie zmienia się.
W 1833 roku angielski fizyk Michael Faraday w trakcie prac eksperymentalnych ustanowił prawo elektrolizy, które obecnie nosi jego imię.
Prawo Faradaya pozwala określić ilość produktów pierwotnych, które są uwalniane na elektrodach podczas elektrolizy. Prawo stanowi, co następuje: „Masa m substancji uwolnionej na elektrodzie podczas elektrolizy jest wprost proporcjonalna do ładunku Q, który przeszedł przez elektrolit”.
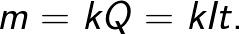
Współczynnik proporcjonalności k w tym wzorze nazywany jest równoważnikiem elektrochemicznym.
Masa substancji uwalnianej na elektrodzie podczas elektrolizy jest równa całkowitej masie wszystkich jonów, które dotarły do tej elektrody:
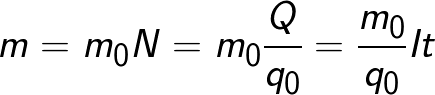
Wzór zawiera ładunek q0 i masę m0 jonu, a także ładunek Q, który przeszedł przez elektrolit.N to liczba jonów, które dotarły do elektrody, gdy ładunek Q przeszedł przez elektrolit.Dlatego stosunek masy jonu m0 do jego ładunku q0 nazywany jest elektrochemicznym równoważnikiem k.
Ponieważ ładunek jonu jest liczbowo równy iloczynowi wartościowości substancji i ładunku elementarnego, równoważnik chemiczny można przedstawić w następującej postaci:
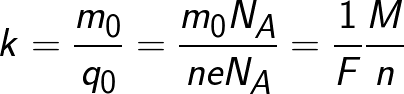
Gdzie: Na to stała Avogadro, M to masa molowa substancji, F to stała Faradaya.
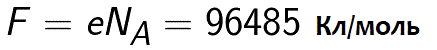
W rzeczywistości stałą Faradaya można zdefiniować jako ilość ładunku, który musi przejść przez elektrolit, aby uwolnić jeden mol jednowartościowej substancji na elektrodzie. Prawo elektrolizy Faradaya przybiera wtedy postać:
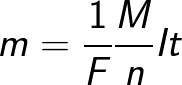
Zjawisko elektrolizy jest szeroko stosowane w nowoczesnej produkcji. Na przykład aluminium, miedź, wodór, dwutlenek manganu i nadtlenek wodoru są produkowane przemysłowo przez elektrolizę. Wiele metali jest wydobywanych z rud i przetwarzanych przez elektrolizę (elektrorafinacja i elektroekstrakcja).
Również dzięki elektrolizie źródła prądu chemicznego… Elektrolizę stosuje się w oczyszczaniu ścieków (elektroekstrakcja, elektrokoagulacja, elektroflotacja). Wiele substancji (metale, wodór, chlor itp.) otrzymuje się przez elektrolizę do galwanizacji i galwanizacji.
Zobacz też:Produkcja wodoru metodą elektrolizy wody — technologia i urządzenia

