Prawa elektrolizy Faradaya
Prawa elektrolizy Faradaya to relacje ilościowe oparte na badaniach elektrochemicznych Michaela Faradaya, które opublikował w 1836 roku.
Prawa te określają zależność między ilością uwalnianych substancji podczas elektrolizy oraz ilość energii elektrycznej przepuszczonej przez elektrolit. Prawa Faradaya są dwa. W literaturze naukowej i podręcznikach można znaleźć różne sformułowania tych praw.
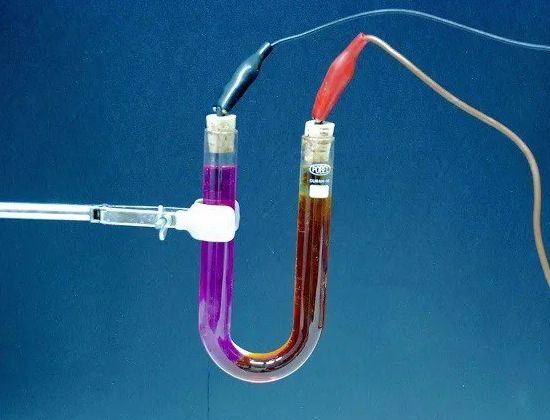
Elektroliza — uwalnianie z elektrolitu substancji składowych podczas przejścia Elektryczność… Na przykład, gdy prąd elektryczny przepływa przez lekko zakwaszoną wodę, woda rozkłada się na części składowe — gazy (tlen i wodór).
Ilość substancji uwolnionej z elektrolitu jest proporcjonalna do ilości energii elektrycznej przechodzącej przez elektrolit, to znaczy iloczynu siły prądu razy czas, w którym ten prąd płynie. Dlatego zjawisko elektrolizy może służyć do pomiaru siły prądu i określenia obecne jednostki.
Elektrolit — roztwór i ogólnie złożona ciecz przewodząca prąd elektryczny.W akumulatorach elektrolit jest roztworem kwasu siarkowego (w ołowiu) lub roztworem potażu kaustycznego lub sody kaustycznej (w żelazo-niklu). W ogniwach galwanicznych rolę elektrolitu pełnią również roztwory dowolnych związków chemicznych (amoniak, siarczan miedzi itp.).
Michaela Faradaya (1791 - 1867)
Michael Faraday (1791 — 1867) — angielski fizyk, twórca nowożytnej doktryny zjawisk elektromagnetycznych. Karierę zawodową rozpoczął jako praktykant w warsztacie introligatorskim. Otrzymał tylko podstawowe wykształcenie, ale samodzielnie studiował nauki ścisłe i pracował jako asystent laboratoryjny u chemika Devi, stał się wielkim naukowcem, jednym z największych fizyków doświadczalnych.
Farraday się otworzył zjawisko indukcji elektromagnetycznej, prawa elektrolizy, rozwinął i położył doktrynę pól elektrycznych i magnetycznych podstawy współczesnych koncepcji pola elektromagnetycznego… Był pierwszym naukowcem, który wpadł na pomysł wibracyjnej, falowej natury zjawisk elektromagnetycznych.
Pierwsze prawo elektrolizy Faradaya
Masa substancji, która wytrąci się na elektrodzie podczas elektrolizy, jest wprost proporcjonalna do ilości energii elektrycznej przeniesionej na tę elektrodę (przepuszczonej przez elektrolit). Ilość energii elektrycznej odnosi się do ilości ładunku elektrycznego, zwykle mierzonego w wisiorkach.
Drugie prawo elektrolizy Faradaya
Dla danej ilości energii elektrycznej (ładunku elektrycznego) masa pierwiastka chemicznego, który zostanie osadzony na elektrodzie podczas elektrolizy, jest wprost proporcjonalna do równoważnej masy tego pierwiastka. Równoważna masa substancji to jej masa molowa podzielona przez liczbę całkowitą, zależną od reakcji chemicznej, w której bierze udział substancja.
Lub
Ta sama ilość energii elektrycznej prowadzi do uwolnienia równoważnych mas różnych substancji na elektrodach podczas elektrolizy. Aby uwolnić jeden mol równoważnika dowolnej substancji, należy wydać taką samą ilość energii elektrycznej, a mianowicie 96485 C. Ta stała elektrochemiczna nazywa się liczba Faradaya.
Prawa Faradaya w formie matematycznej
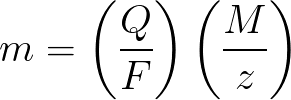
-
m jest masą substancji osadzonej na elektrodzie;
-
Q jest wartością całkowitego ładunku elektrycznego w zawieszkach, przekazanego podczas elektrolizy;
-
F = 96485,33 (83) C / mol — liczba Faradaya;
-
M to masa molowa pierwiastka wg/mol;
-
z — liczba walencyjna jonów substancji (elektrony na jon);
-
M / z — równoważna masa substancji nałożonej na elektrodę.
W zastosowaniu do pierwszego prawa elektrolizy Faradaya M, F i z są stałymi, więc im więcej Q, tym więcej m.
Jeśli chodzi o drugie prawo elektrolizy Faradaya, Q, F i z są stałymi, więc im więcej M / z, tym więcej będzie m.
Dla prądu stałego mamy
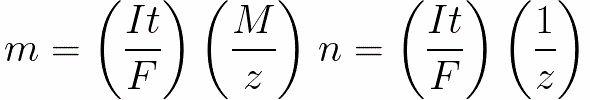
-
n to liczba moli (ilość substancji) uwolnionych na elektrodzie: n = m / M.
-
t to czas przepływu prądu stałego przez elektrolit. W przypadku prądu przemiennego całkowity ładunek jest sumowany w czasie.
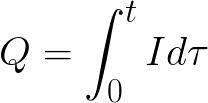
-
t to całkowity czas elektrolizy.
Przykład zastosowania praw Faradaya
Konieczne jest napisanie równań procesów elektrochemicznych na katodzie i anodzie podczas elektrolizy wodnego roztworu siarczanu sodu z obojętną anodą. Rozwiązanie problemu będzie następujące. W roztworze siarczan sodu dysocjuje zgodnie z następującym schematem:
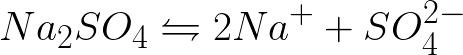
Standardowy potencjał elektrody w tym układzie jest następujący:
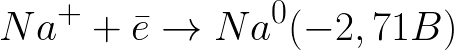
Jest to znacznie bardziej ujemny poziom potencjału niż dla elektrody wodorowej w ośrodku neutralnym (-0,41 V). Dlatego na elektrodzie ujemnej (katodzie) elektrochemiczna dysocjacja wody rozpocznie się od uwolnienia wodoru i jonów wodorotlenkowych zgodnie z następującym schematem:
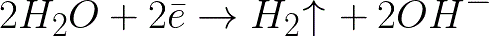
A dodatnio naładowane jony sodu zbliżające się do ujemnie naładowanej katody będą gromadzić się w pobliżu katody, w sąsiedniej części roztworu.
Na elektrodzie dodatniej (anodzie) nastąpi elektrochemiczne utlenianie wody, które doprowadzi do uwolnienia tlenu według następującego schematu:
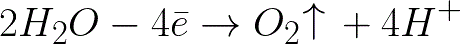
W tym systemie standardowy potencjał elektrody wynosi +1,23 V, czyli znacznie poniżej standardowego potencjału elektrody występującego w następującym systemie:
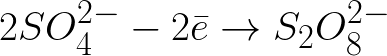
Ujemnie naładowane jony siarczanowe poruszające się w kierunku dodatnio naładowanej anody będą gromadzić się w przestrzeni w pobliżu anody.

